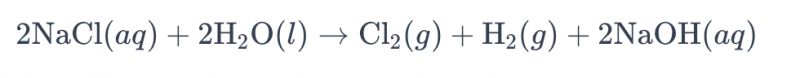Proces elektrolýzy solanky za použití titanových elektrod za účelem výroby chloru se běžně označuje jako „elektrolýza solanky“. V tomto procesu se titanové elektrody používají k usnadnění oxidační reakce chloridových iontů v solance, což vede k tvorbě plynného chloru. Celková chemická rovnice reakce je následující:
V této rovnici podléhají chloridové ionty oxidaci na anodě, což vede k produkci plynného chloru, zatímco molekuly vody se redukují na katodě, čímž vzniká plynný vodík. Kromě toho hydroxidové ionty podléhají redukci na anodě, čímž vzniká plynný vodík a hydroxid sodný.
Volba titanových elektrod je dána vynikající odolností titanu proti korozi a vodivostí, což mu umožňuje stabilní reakci během elektrolýzy bez koroze. Díky tomu jsou titanové elektrody ideální volbou pro elektrolýzu solanky.
Elektrolýza slané vody obvykle vyžaduje externí zdroj energie pro elektrolytickou reakci. Tímto zdrojem energie je obvykle zdroj stejnosměrného proudu (DC), protože elektrolytické reakce vyžadují stálý směr toku proudu a zdroj stejnosměrného proudu může dodávat konstantní směr proudu.
V procesu elektrolýzy slané vody za účelem výroby plynného chloru se běžně používá nízkonapěťový stejnosměrný zdroj napájení. Napětí zdroje napájení závisí na specifických reakčních podmínkách a konstrukci zařízení, ale obecně se pohybuje mezi 2 až 4 volty. Kromě toho je klíčovým parametrem intenzita proudu zdroje napájení, který je třeba určit na základě velikosti reakční komory a požadovaného výtěžku výroby.
Stručně řečeno, volba zdroje energie pro elektrolýzu slané vody závisí na specifických požadavcích experimentů nebo průmyslových procesů, aby byla zajištěna efektivní reakce a dosažení požadovaných produktů.
Čas zveřejnění: 16. ledna 2024